免疫检查点抑制剂(ICIs)耐药性限制了肝细胞癌(HCC)免疫治疗的成功。然而,免疫治疗耐药的机制仍然难以捉摸。
2024年2月22日,复旦大学李辉、郭磊、叶青海、樊嘉及中国台湾中国医科大学洪明奇(Mien-Chie Hung)等合作在Journal of Hepatology 在线发表题为“CRKL dictates anti-PD-1 resistance by mediating tumor-associated neutrophil infiltration in hepatoce”的研究论文,该研究发现CRKL通过介导肝癌中肿瘤相关的中性粒细胞浸润来调控抗PD-1的耐药性。CRKL是一种候选抗PD-1耐药基因。CRKL过表达通过动员肿瘤相关中性粒细胞(TANs)阻断CD8+ T细胞的浸润和功能而使抗PD-1治疗效果无效。PD-L1+ TANs被发现是TANs的一个重要子集,受CRKL表达调节,并表现出免疫抑制表型。
在机制上,CRKL通过竞争性地降低Axin1结合抑制APC介导的β连环蛋白蛋白酶体降解,从而促进VEGFα和CXCL1的表达。使用人类HCC样本,验证了CRKL/β-catenin/VEGFα与CXCL1的正相关。利用CRISPR-Cas9基因编辑(CRKL敲除)靶向CRKL或其下游调节因子,在原位小鼠模型和患者源性器官型肿瘤球体(PDOTS)模型中有效恢复抗PD-1治疗的疗效。CRKL/β-catenin/VEGFα和CXCL1轴的激活是成功抗PD-1治疗的关键障碍。因此,CRKL抑制剂联合抗PD-1可能用于治疗HCC。

肝细胞癌(HCC)是全球癌症相关死亡的第三大原因。虽然HCC治疗有了很大的进步,但大多数HCC患者不符合手术切除标准。免疫检查点抑制剂(ICIs)在癌症免疫治疗领域取得了不可磨灭的成就;根据III期临床试验IMBrave150的阳性结果,atezolizumab+贝伐单抗已成为晚期HCC患者的一线联合治疗方案。然而,其他针对HCC患者的抗PD-1治疗的随机临床试验并没有显示出显著的改善,从而表明存在形成HCC复杂免疫抑制微环境的机制,以驱动抗PD-1治疗的耐药,突出了迫切需要确定更好的生物标志物,以优化患者选择和克服免疫治疗耐药。
中性粒细胞是人体中最丰富的循环白细胞,在多种癌症类型中积累。肿瘤中的中性粒细胞表现出显著的可塑性,并在T细胞炎症微环境中获得T细胞抑制能力。中性粒细胞可通过释放抗肿瘤因子如TSP-1和H2O2来抑制肿瘤进展,并在免疫治疗中获得抗肿瘤表型,从而发挥抗肿瘤作用。然而,更多的研究表明,肿瘤相关中性粒细胞(TANs)具有促肿瘤作用,包括免疫耐受。在一些实体人肿瘤中,TANs的高水平浸润有助于肿瘤进展、淋巴结转移、血管生成和预后不良,强调了TANs在协调免疫抑制肿瘤微环境(TME)和免疫治疗耐药在预后不良中的关键作用。
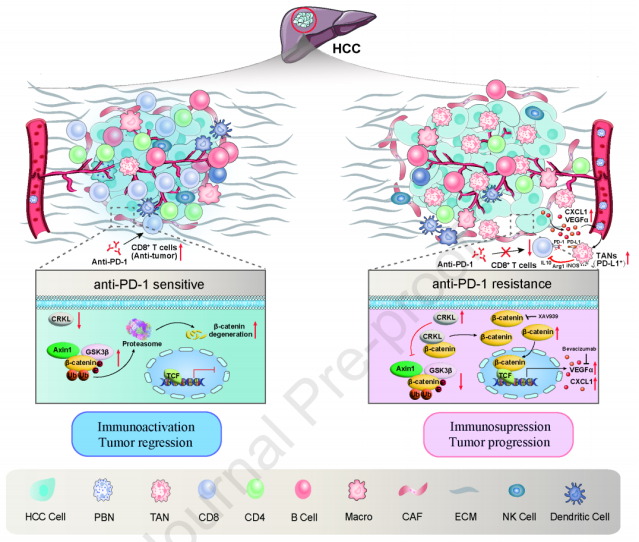
机理模式图(图源自Journal of Hepatology )
人类激酶样基因(CRKL)的CT10调控因子位于染色体22q11.21上。CRKL是一种连接蛋白,由一个Src同源2 (SH2)结构域和两个SH3结构域组成。已经鉴定出几种与SH2和N端SH3结构域结合的蛋白。CRKL普遍表达,并参与多种生物过程,介导细胞增殖、迁移、粘附、细胞骨架变化、分化、吞噬和病原体摄取。CRKL在多种癌症中表达升高,CRKL的扩增驱动癌转化和表皮生长因子受体(EGFR)抑制剂耐药性。这些发现表明,异常的CRKL表达在肿瘤进展中起着重要作用。
该研究发现CRKL在抗PD-1耐药的HCC组织中表达上调,CRKL过表达通过募集TANs和重塑肿瘤免疫微环境(TIME)促进抗PD-1耐药,提示CRKL是克服抗PD-1耐药的潜在靶点。这些发现支持以贝伐单抗为基础的ICIs联合治疗策略,CRKL抑制剂联合抗PD-1治疗可能被开发用于HCC的治疗。
原文链接:https://doi.org/10.1016/j.jhep.2024.02.009













